- 首页 > 流式细胞分选
流式细胞分选
2013年,单细胞技术被《Nature Method》杂志评为年度技术,被《Science》杂志评为六大前沿领域之首。如今随着高通量单细胞技术方法的推广,单细胞研究成本降低,单细胞研究服务可以“飞入寻常百姓家”,极大地推动单细胞研究发展。
当然,单细胞研究中,一个很重要的方法——流式细胞分选法的出现,让单细胞研究可以实现有目的性细胞群体的富集,研究范围进一步缩小,带来的是对单细胞群体的精细化了解,让未来的靶向药物研究设计和治疗更有针对性。
现华大科技引进SONY SH800S Flow Cell Sorter流式细胞分选仪,可实现3规格、4模式,满足单细胞多种类型研究需求。分选后的细胞能直接用于核酸提取、单细胞PCR扩增或10X Genomics等,可进一步进行细胞基因、功能水平的研究和不同细胞之间的差异化研究。
流式细胞分选技术原理
利用流式细胞分选仪,以高能量激光照射高速流动状态下被荧光色素染色的单细胞或微粒,测量其产生的散射光和发射荧光的强度,从而对细胞(或微粒)的物理、生理、生化、免疫、遗传、分子生物学性状及功能状态等进行定性或定量检测的一种现代细胞分析技术,它可根据发射光的荧光强度和波长将发光颗粒亚群分开并可实现单克隆分选,复杂样本中的细胞进行分类、定量和分离。
流式细胞仪分选模式
- 单管单细胞分选
- 96孔板/384孔板
- 特定类群细胞分选
流式细胞仪配置
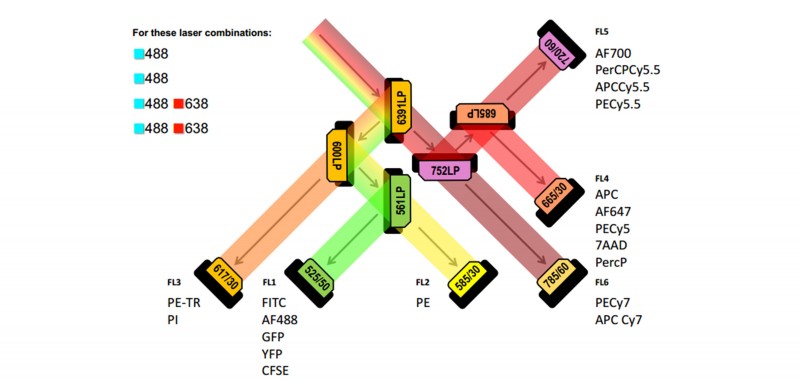
图1 华大科技流式细胞仪配置图
流式细胞分选实验流程
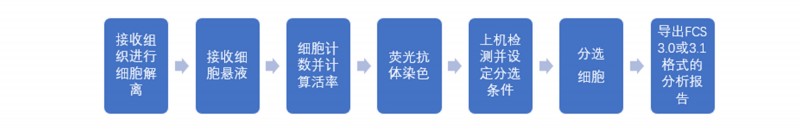
图2 流式细胞仪分选实验操作流程图
产品优势
多样:3种规格芯片(70um/100um/130um),充分满足不同大小细胞的分选需求;
全面:4种分选模式(0.2ul PCR管/96孔板/384孔板/特殊细胞群),满足不同类型单细胞研究需求;
先进:创新微流体芯片液流分选系统,全自动化校准;
精准:独有专利技术,细胞的损伤小,活细胞比例高,纯度达99%;
灵活:接受多种组织、细胞系类型,提供组织解离处理。
(一)抗体标记分选:
经抗体标记(CD4-FITC/CD8-PE,Invitrogen)标记的抗凝全血,分选CD4+和CD8+细胞,结果展示如下,观察到CD4+和CD8+两类细胞分群明显,并按照下图方案,对其中CD4+和CD8+细胞进行圈门。
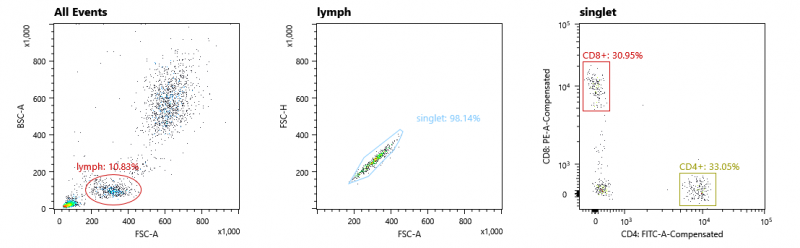
图3. 细胞分群结果示意图
(二)单细胞模式分选:
1. 取96孔板,圈定CD4+细胞,并选择96孔板分选,single cell模式;
2. 向A1/B1/G2/H2孔分别喷入1个细胞,向C1/D1/E2/F2孔分别喷入10个细胞,向E1/F1/C2/D2孔分别喷入100个细胞,向G1/H1/A2/B2孔分别喷入1000个细胞;
3. 将以上细胞使用smart-seq2方法进行单细胞扩增,并使用Agilent 2100检测扩增产物。
结果展示如下图,文库主峰大于1kb为正常,且随着细胞数目增加,产物的量随之增加。
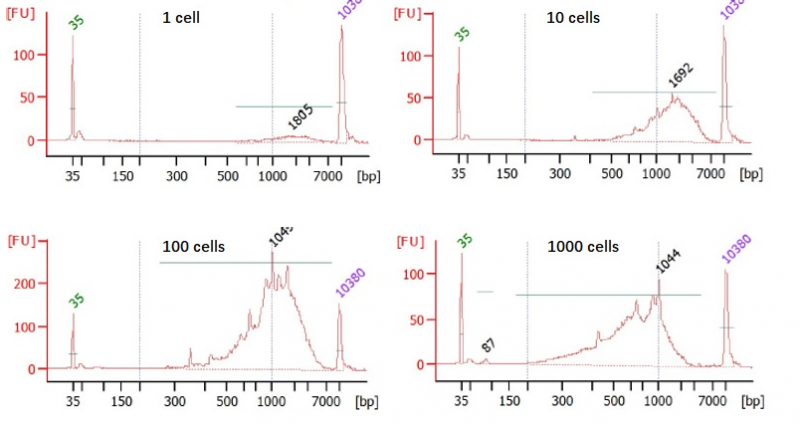
图4. smart-seq2扩增文库2100检测图
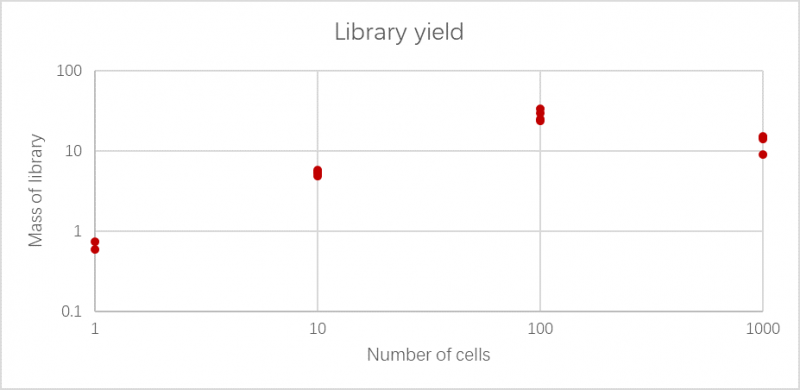
图5. 文库产量图
(三)细胞类群分选:
1. 取2个15ml离心管,圈定CD4+细胞及CD8+细胞,purity模式两路分选;
2. 离心管中加入100ul细胞培养液DMEM(Gibco),收集105个细胞;
3. 取分选后的CD4+台盼蓝染色,显微镜下观察,拍照如下图。
细胞观察,显微镜拍照。台盼蓝不能穿过完整的细胞膜,因此视野里的亮点,是活的细胞;被染蓝色的,是死细胞。

图6. 细胞染色显微镜图
4. 取分选后的CD4+细胞,加入900ul trizol裂解液(Invitrogen),并完成RNA提取实验;使用Agilent 2100检测提取产物,结果如下图,CD4+细胞,提取后的RNA质量良好。
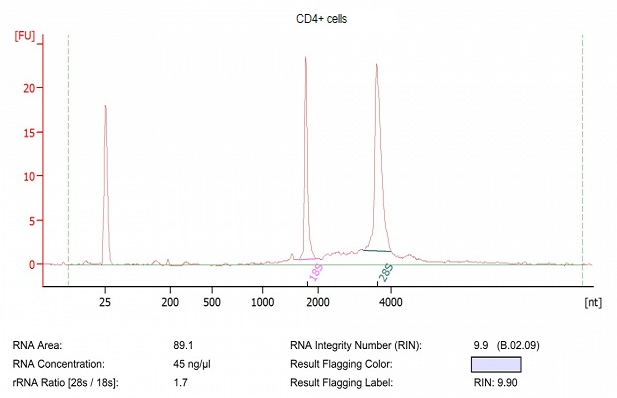
图7. 提取RNA质量检测图
|
组织类型 |
详细要求 |
|
单细胞悬液 |
细胞直径<40 μm、细胞活性>60%;无结团和碎片,细胞密度不超过1×107/ml |
|
全血 |
全血样本在送样前应充分与抗凝剂混合,确认血样没有溶血或凝结,并尽快安排实验 |
|
其他组织 |
送样前先以无菌PBS清洗后再无菌条件下充分剪为碎块,依据组织类型选择合适的完全培养液低温运输 |
注意事项:
1、如单一荧光检测,需要提供未进行标记抗体的细胞一份,作为阴性对照; 如多色荧光检测,除阴性对照外,还须提供多个单色补偿对照。
2、选择合适的荧光抗体标记目标细胞,当试验中所涉荧光素超过三种时,请先与生产负责人确认所选荧光抗体是否合适后再行购买。
Q1:流式细胞仪进行分选细胞,怎样选择抗体标记?
选择抗体的原则:
(1)选择荧光时首先应确认能被流式细胞仪上所配置的激光激发;
(2)激发光谱必须在仪器上滤光片能够接受的合适范围内;
(3)尽量使用已经用荧光素标记好的单克隆抗体;
(4)如果是单色实验,荧光素的亮度越强越好;
(5)如果是多色实验,除了避免使用光谱高度重叠的荧光素外,还应搭配染色指数。简单来说,就是用亮度强的荧光素标记抗体水平低的抗原,而用较弱的荧光素标记抗体水平高表达的抗原。
Q2:抗体需要客户提供吗?
需要,华大也会配备5种抗体(物种:人),CD3/ CD4/ CD8/CD19/CD45。
Q3:哪些情况下必须用流式细胞仪来进行细胞分选?
(1)要求目标细胞群有极高的纯度(95%-100%);
(2)需要分选低密度表面受体/抗原的细胞(弱阳性细胞);
(3)需要根据表面受体密度的差别来分离不同细胞(根据免疫表型的分选、抗体亲和力进化等);
(4)需要依据多色荧光标记来分选细胞;
(5)根据某些细胞内部标志,如DNA含量、包内抗原等分离细胞;
(6)多孔板分选,如96孔板或384孔板中精确的分选出1个细胞;
(7)分选含量极低的细胞(0.001%或更低),流式可分选出百万分之一的稀有细胞。
Q4:MACS和FACS进行细胞分选的优缺点?
MACS(magnetic-activated cell sorting),原理就是用结合了磁珠的抗体去标记细胞,让目的细胞带上磁珠,通过磁场将结合了磁珠与没结合磁珠的细胞分离开来。
FACS(fluorescence-activated cell sorting),流式分选则是利用荧光素标记不同的分子,通过调节合适的电压、补偿等,通过荧光将目的细胞与非目的细胞区分开来。华大科技引进的SONY流式细胞分选平台,在保证分选纯度的同时,通过专利技术降低分选过程对细胞的损伤,并支持各种收集管耗材,还可以实现索引分选。
FACS与MACS的比较
|
比较内容 |
FACS |
MACS |
|
设备 |
具有分选功能的流式细胞仪 |
专用的磁铁和柱子 |
|
试剂 |
荧光抗体 |
磁珠结合抗体 |
|
操作人员要求 |
需专业培训 |
操作简单 |
|
对细胞刺激 |
稍大 |
小 |
|
多种标记细胞 |
可以分选 |
不能分选 |
|
表达丰度低的细胞 |
可以分选 |
不能分选 |
|
识别细胞大小和颗粒度 |
可以识别 |
不能识别 |
|
多种细胞分选 |
两路同时分选 |
一次只能分选一种细胞 |
Q5:如果我想在分选后拿到1×105个细胞,用于单细胞研究,那么应该准备多少细胞来做分选?
首先需要确认,要分选的目的细胞占总细胞数的占比。
以PBMC分选T细胞为例,其中T细胞占比约70%,
PBMC are not a homogenous cell population but are constituted by several immunecell types including, among others, B cells (~15 %), T cells (~70 %), monocytes (~5 %), and natural killer (NK) cells (~10 %)。
细胞数要求是≥105= 所需细胞总数*目标细胞占比(变量)%*分选纯度98%(固定值)*分选效率80%(固定值,根据分选模式会有差异, 高速分选、 纯度模式(purity vs. yield mode)、部分细胞黏附于上样管壁、部分细胞用于样本分析、长时间分选过程中细胞的死亡等等,对会降低回收率。80%回收率是一个一般的参考值)
根据计算,100000/80%/98%/70%(变量)= 182215 ,所以约为~20W个细胞总数。其他以此方法进行计算类推。

