- 首页 > PRM目标蛋白定量分析
PRM目标蛋白定量分析
PRM作为靶向蛋白质组研究策略,可以有目标地检测分析特定的关键蛋白质在多样本中的含量变化情况的高通量检测技术产品。PRM技术借助Q-Orbitrap为代表的四极杆-高分辨质谱平台进行数据采集,在四级杆(Q1)选出的目标肽段离子,进入碰撞室中打碎,所有的碎片离子经过质量分析器产生一张高分辨的二级质谱图,通过提取其中的碎片离子信息即可实现目标肽段的定量。
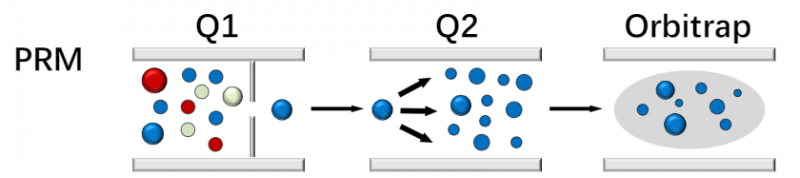
图1 目标蛋白MRM/PRM技术原理介绍
产品优势
- 通量高:一次上机检测,可同时得到几十甚至上百种目标蛋白的定量信息
- 周期短:无需抗体制备和Western Blotting实验过程,极大缩短了项目周期
- 准确性高:通过对目标蛋白母子离子对或母离子的选择,去除干扰离子,靶向精确定量
- 特异性高:避免抗体制备过程中引入的非特异性结合因素,高效筛选目标蛋白。
产品应用
- 大范围蛋白质组检测后的目标蛋白验证
- 同源蛋白或突变蛋白定量研究
- 开发临床诊断预测试剂盒
技术路线
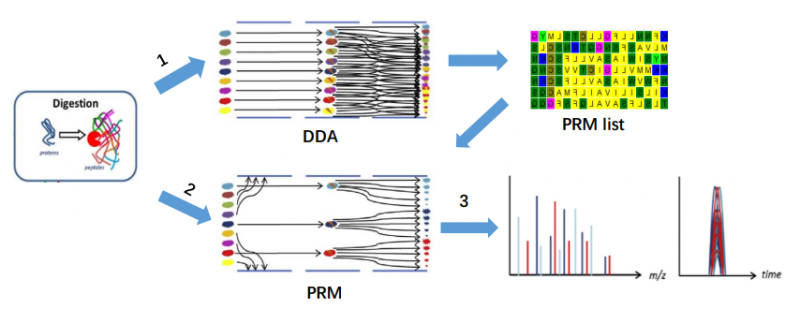
图2 技术流程图
1、使用 Orbitrap 系列质谱仪进行 DDA(数据依赖性采集)模式采集数据,筛选出可检测的目标肽段 PRM list;
2、对靶标肽段离子进行 PRM 模式检测,获得子离子的信号;
3、通过分析软件(如 Skyline)进行特征子离子的筛选和峰面积积分,得到高分辨、高特异性的蛋白相对定量值。
信息分析流程
1、方法建立
1)目标蛋白总结;
2)数据质控;
3)PRM方法展示。
2、样本检测
1)定量信息;
2)数据归一化;
3)目标蛋白相对定量。
3、定制化信息分析
可结合客户的需求,协商确定定制化信息分析内容。
1、DIA+PRM鉴定新冠重症生物标志物(华大合作案例)
Multi-platform omics analysis reveals molecular signature for COVID-19 pathogenesis, prognosis and drug target discovery. Signal Transduction and Targeted Therapy. 2021
背景:
新冠肺炎肆虐已久,截止2021年8月,全球累计确诊超2.8亿例,其最常见的临床症状是肺炎伴发热、咳嗽和呼吸困难。根据《中国政府诊疗指南(试行第七版)》,COVID19患者根据其不同的临床表现分为四个亚组:轻症、普通、重症和危重症。重症患者的死亡率远高于非重症患者,但目前仍没有针对重症患者治疗的相关药物获批,标准治疗往往是支持措施如引入呼吸机等。因此,寻找能够从分子层面预测患者疾病严重程度的生物标志物,将有助于指定更有针对性的诊疗和支持措施,提高新冠患者的生存率和预后效果。
实验设计:
对发现队列10名重症患者、10名非重症患者和10名健康志愿者共计30例血浆样品,进行DIA蛋白定量、脂质组和氨基酸检测,建立随机森林机器学习模型,对筛选到的用于预测新冠严重程度的生物标志物利用MRM/PRM在两个验证队列中进行验证。
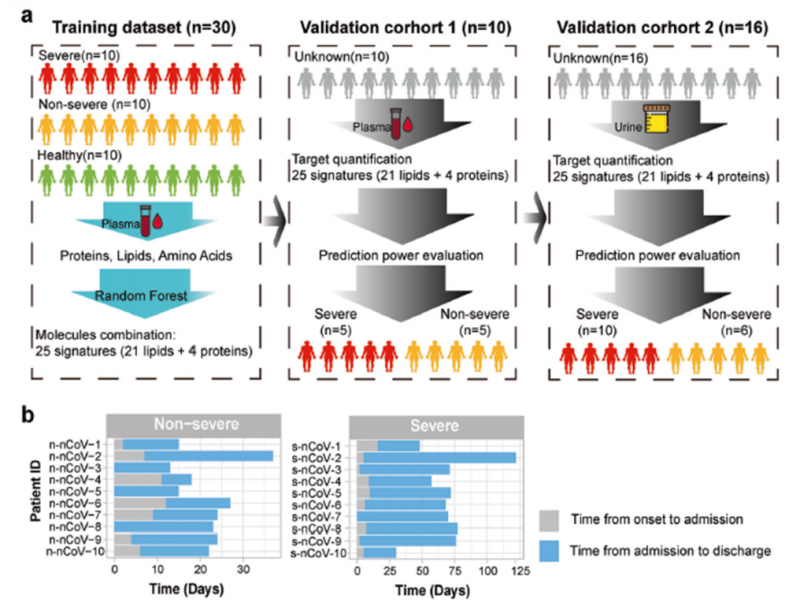
图1 研究样品及多组学流程
主要结果:
1) 对发现队列共计30例血浆样品,进行DIA蛋白定量、脂质组和氨基酸检测,分别定量到1,254个蛋白质、664个脂质小分子和16种氨基酸,并与公共数据集互补。发现了独特的蛋白质特征,例如TETN和CAMP,它们可用作COVID-19的新潜在药物靶标或生物标志物。
2) 对发现队列的蛋白质组、脂质组和氨基酸检测数据,建立随机森林机器学习模型,初步筛选到21个脂质和4个蛋白质,共计25个物质组成的panel可作为潜在的预测疾病严重程度的生物标志物;并进一步采用MRM或PRM在两个验证队列中进行了验证。
2、青稞β-葡聚糖合成和积累分子机制研究
Quantitative Proteome Profiling Provides Insight into the Proteins Associated with β-Glucan Accumulation in Hull-less Barley Grains. J Agric Food Chem. 2021
背景:
青稞是中国藏区广泛种植的主要粮食作物,其籽粒中β-葡聚糖(BG)含量较高。但从蛋白质水平考察青稞BG合成和积累机制的究还很缺乏。
研究思路:
利用TMT定量蛋白质组学方法,对开花后20、30、40d的青稞种子蛋白质组进行比较。
主要结果:
1) 共鉴定出4,283个蛋白质,其中759个在种子发育过程中差异表达;
2) 发现细胞壁修饰、碳和能量代谢、多糖代谢、转录后修饰和囊泡转运是青稞 BG 积累相关的关键生物过程。淀粉合成酶、淀粉分支酶、果胶乙酰酯酶、β- 葡萄糖苷酶、β-淀粉酶、1,4-β-木聚糖等与BG的合成有关。参与糖酵解、糖异生和乙醛酸旁路途径的蛋白质为BG的储存提供能量和还原能力;
3) PRM和qPCR证实了基于TMT获得的蛋白质表达谱。
1、PRM数据归一化
本项目利用外参蛋白Biognosys|iRT-Kit_WR_fusion的方法进行数据归一化,以降低PRM非标定量的实验误差。一般情况下,所有transition的信号都会用于目标蛋白的定量,但是如果发现个别transition由于背景干扰导致强度跟其他transition不一致,则会去除这些transition。目标蛋白的每个transition的信号会通过Biognosys|iRT-Kit_WR_fusion的信号进行归一化。
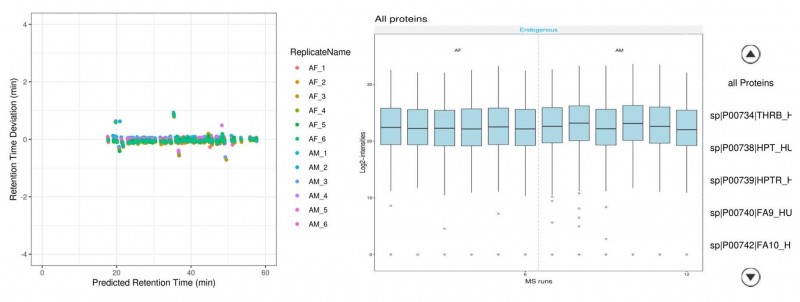
图2 数据归一化过程
左图为目标蛋白每个肽段的色谱出峰时间误差,RT≤±2min;右图为目标蛋白所有transition归一化强度分布
2、目标蛋白相对定量
在提取目标蛋白所有归一化强度后,本项目利用一个线性混合模型进行目标蛋白在样品中的相对定量,此模型整合在MSstats工具包中[3],该统计分析会给出蛋白在比较组的比值以及校正p值(adjusted p-value)。校正p值也反映原始统计检验的假阳性(Benjamini and Hochberg方法),目标蛋白在1.5倍差异且校正p值<0.05(假阳性<0.05)的条件下认为是差异蛋白。
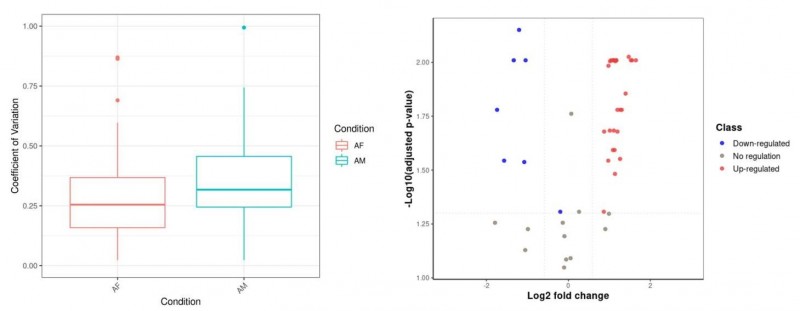
图3 目标蛋白相对定量
其中,左图为目标蛋白所有肽段质定量信息变异系数分布,一般认为80%的肽段CV<20%为数据质量好;右图为目标蛋白在所有比较组的相对定量分布,横坐标为比值取log2,纵坐标为校正p值取-log10,目标蛋白在1.5倍差异且校正p值<0.05的条件下认为是差异蛋白。
1、组织类样品送样要求
表1 组织类样品送样要求
| 样品类型 | 送样量 | 备注 |
| 新鲜动物组织干重 | ≥10mg | 富含杂质或蛋白质含量低的样品量干重≥5g,如植物的根、木质部、韧皮部组织等 |
| 植物、蕈类真菌(如蘑菇、木耳)类 样品量湿重 |
≥300mg | |
| 酵母、霉菌类真菌和细菌、噬菌体等微生物 | ≥50mg,或细胞数≥5×106 | |
| 新鲜培养细胞数(个) | ≥1×107(细胞沉淀体积约30μl~50μl左右) | |
| 客户分离好的外泌体 | ≥50μg,浓度≥0.5μg/μL | |
| 血液类(去高丰度) | 血清、血浆≥200µL | 解冻后血细胞会破裂,蛋白溶出来会影响分析,因此一般不建议送全血 |
2、蛋白类样品送样要求
表2 蛋白类样品送样要求
|
样本类型 |
送样量 |
|
蛋白液 |
≥100μg,浓度≥0.5µg/µL |
Q1:只知道蛋白序列,PRM技术能否像Western blot技术一样精确的找到该蛋白并对它的量进行分析?
A1:有目标蛋白的序列信息,PRM是可以替代Western lot技术进行目标蛋白的精确定量,定性和差异分析。
Q2: PRM技术进行质谱时,可以一次监测多少个蛋白?是只能对一个特定蛋白监测,还是多个特定蛋白同时监测?
A2:主要根据蛋白丰度和样本基质的情况决定,不同样本不同蛋白的理化性质不一样,一般情况下, PRM技术可以同时检测几十到上百个蛋白质。
Q3:如果不知道蛋白质的信息,能否进行PRM?若只有基因组的信息,能否进行?
A3:进行PRM必须明确知道目标蛋白质,并获得蛋白质的全序列;如果有基因组信息,一般都会有预测编码蛋白序列,可以先翻译成氨基酸序列再进行PRM。

